|
Pile, électrolyse, transformations inversables concours kiné Ceerrf 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On considère la transformation modélisée par l'équation : Ni(s) + Cu2+aq = Cu(s) + Ni2+aq de constante d'équilibre K = 2 1019. Les solutions utilisées ont toutes deux les concentrations de 0,10 mol/L en ions Cu2+aq et Cu2+aq et un volume V = 200 mL dans chaque compartiment. Exprimer puis calculer le quotient de réaction initial Qr i relatif à l'équation écrite précédemment. Qr i =[Ni2+aq]i / [Cu2+aq]i = 0,10 / 0,10 = 1. Dans quel sens va évoluer le système si on relie les plaques métalliques par un conducteur ohmique ? Justifier. Qr i < K, donc évolution dans le sens direct. On fait débiter par la pile ainsi obtenue, un courant d'intensité I= 20 mA pendant 10 heures. Quel est l'avancement de la réaction au bout de cette durée ? Aide au calcul : 72/193 = 0,37. Quantité d'électricité : Q = I t = 0,02 * 10*3600 = 720 C Quantité de matière d'électrons n(e-) = Q / 96500 = 720 / 96500 = 72 / 9650 mol Or Cu2+aq + 2e- = Cu(s) d'où la quantité de matière de cuivre : n(Cu(s) = ½n(e-) = 72/( 2*96,5*100) = 72 / 193 10-2 = 3,7 10-3 mol. L'avancement est égal à la quantité de matière de cuivre formé : x = 3,7 10-3 mol. 0,02-3,7 10-3 =0,0163 = 0,0237 Calculer le quotient de réaction final Q r 10 et le comparer à Q r i et K. Faire un commentaire sur l'état d'évolution du système. Qr 10 =[Ni2+aq]f / [Cu2+aq]f = 0,1185 / 0,0815 =1,45 ~ 1,5. Valeur supérieure à Qr i mais inférieur à K : le système va encore évoluer dans le sens direct tant que le circuit extérieur sera fermé.
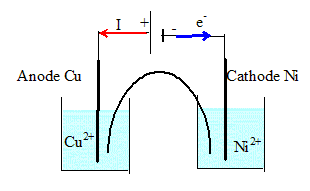
Au bout de ces 10 heures de fonctionnement on veut réaliser la transformation inverse de celle qui a été effectuée ci-dessus. Ecrire son équation. Cu(s) + Ni2+aq = Ni(s) + Cu2+aq de constante d'équilibre 1/ K = 1/ 2 1019 =5 10-20. Faire un schéma légendé du montage en précisant la nature des pôles de chaque dipôle.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|