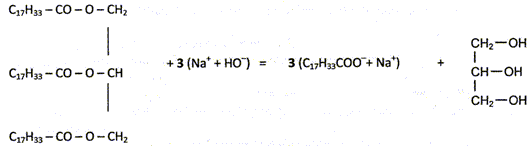|
Fabrication d'un savon, concours manipulateur radio Poitiers 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
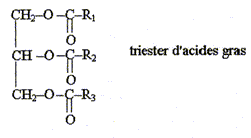
La saponification est l'action d'une solution concentrée de base forte ( hydroxyde de sodium ou de potassium) sur un ester. Les graisses animales ou végétales sont constituées par des triesters du glycérol et d'acides gras, leur formule générale est :
où R1, R2, R3 sont des chaînes carbonées non ramifiées, par exemple telles que R1= R2= R3= -C17H33. On donne ci-dessous l'équation chimique de la réaction de saponification du triester ( ou triglycéride) de l'acide oléïque. oléine + hydroxyde de sodium = oléate de sodium ( savon) = glycérol.
R-COO-R' + (Na+ + HO- ) --> R-COO- + Na+ + R'-OH. Pourquoi obtient-on l'ion carboxylate et non pas l'acide carboxylique ? A pH supérieur à pKa, la forme base conjuguée du couple acide / base prédomine. Or en présence de base concentrée, le pH est proche de 13, valeur bien supérieur au pKa : la forme R-COO- est largement majoritaire. En comparant cette réaction avec l'hydrolyse d'un ester en milieu neutre, expliquer pourquoi la réaction de saponification est totale. L'hydrolyse d'un ester en milieu neutre conduit à la formation d'un acide et d'un alcool ; l'acide réagit avec l'alcool pour conduire à l'ester : on aboutit à un équilibre. La saponification se déroule en présence d'une base concentrée ; la forme acide carboxylique du couple acide /base est très minoritaire. Il n'y a donc pratiquement pas d'alcool qui réagit avec l'acide, réactif limitant.
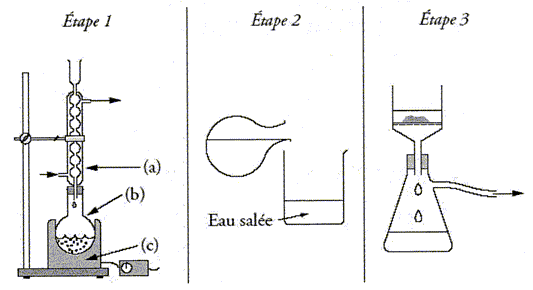
Saponification. Etape 1 : dans un ballon (b) introduire 10 g d'huile, 20 mL de soude à 7,5 mol/L et 10 mL d'éthanol. Agiter pour homogénéiser le mélange et ajouter 3 grains de pierre ponce - Placer le ballon dns le chauffe ballon (c) et adapter un réfrigérant à eau( a) - Chauffer à reflux pendant 30 min Etape 2 : Préparer un becher de 100 mL d'eau et 20 g de chlorure de sodium - à la fin du chauffage verser le mélange chaud dans le becher contenant l'eau salée froide. Etape 3 : Filtrer sur Büchner ; récupérer le savon et sécher.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|