|
cinétique, conductivité, 2-chloro-2-méthylpropane bac S 2007 Afrique |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
On peut modéliser cette transformation par : (CH3)3C-Cl+2H2O =(CH3)3C-OH + H3O+ + Cl-. Masse molaire du 2-chloro-2-méthylpropane : M= 92,0 g/mol ; masse volumique: r= 0,85 g/mL Conductivités molaires ioniques en S m2 mol-1 : lH30+=349,8.10-4 ; lCl-= =76,3.10-4. Protocole observé: Dans une fiole jaugée, on introduit 1,0 mL de 2-chloro-2-méthylpropane et de l'acétone afin d'obtenir un volume de 25,0 mL d'une solution S. Dans un bécher, on place 200,0 mL d'eau distillée dans laquelle est immergée la sonde d'un conductimètre. Puis à l'instant t = 0 min, on déclenche un chronomètre en versant 5,0 ml de la solution S dans le bêcher. Un agitateur magnétique permet d'homogénéiser la solution obtenue, on relève la valeur de la conductivité du mélange au cours du temps.
Quantité initiale de 2-chloro-2-méthylpropane introduite dans le dernier mélange : masse (g) = volume (mL)*masse volumique (g/mL) m =V r= 1,0*0,85 = 0,85 g. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) n = m/M = 0,85 / 92,0 = 9,24 10-3 mol dans 25 mL soit n0 = 9,24 10-3 /5 ; n0 = 1,8 10-3 mol dans 5 mL. Tableau d'avancement :
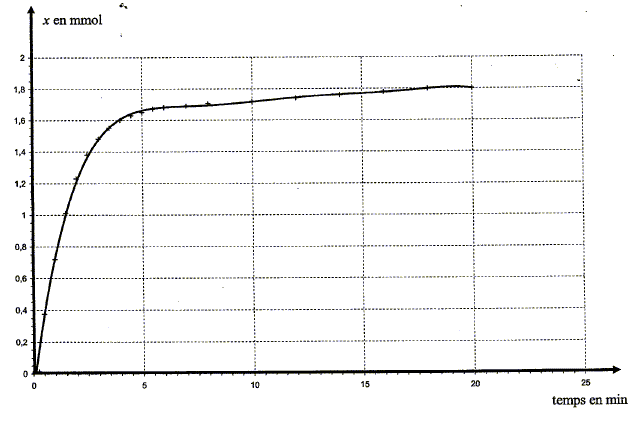
Expression de la conductivité s du mélange en fonction de [H3O+] et des conductivités molaires ioniques : s =lH30+[H3O+] +lCl- [Cl-] ; s = (lH30+ + lCl- ) [H3O+] avec [H3O+] en mol m-3. s = (lH30+ + lCl- ) x/V avec V en mol m3. Vérifions que la transformation envisagée est bien totale : Pour un temps très grand, la conductivité notée s00 du mélange ne varie plus. s00 = 0,374 S.m-1, lH30+=349,8.10-4 ; lCl- =76,3.10-4 S.I, V = 205 mL =2,05 10-4 m3. x00= s00 V / (lH30+ + lCl- ) x00=0,374*2,05 10-4 /((349,8 + 76,3)10-4 ) =1,8 10-3 mol. On constate que x00= xmax = n0 : la transformation est totale. Expression du rapport s /s00 : s = (lH30+ + lCl- ) x/V ; s00 = (lH30+ + lCl- ) xmax/V ; s /s00 = x/xmax. Expression de l'avancement x en fonction de s, s00 et de l'avancement maximal xmax de la réaction. x= xmax s /s00 Pour s = 0,200 S.m-1, la valeur de x est égale à : x= 1,8 10-3 *0,200 / 0,374 = 9,6 10-4 mol. Exploitation des résultats L'expression établie permet de construire la courbe montrant les variations de l'avancement x de la réaction en fonction du temps.
La vitesse volumique v de réaction est donnée par la relation: v =1/V dx/dt où Vest le volume de la solution et x l'avancement de la réaction.
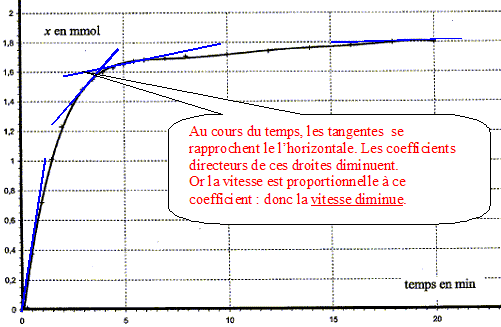
A la date t considérée, tracer la tangente à la courbe x=f(t) Déterminer graphiquement le coefficient directeur [dx/dt]t de cette droite tangente. Diviser ce coefficient par le volume V ( en litre) de la solution. A l'aide de la courbe, indiquer comment évolue cette vitesse au cours du temps.
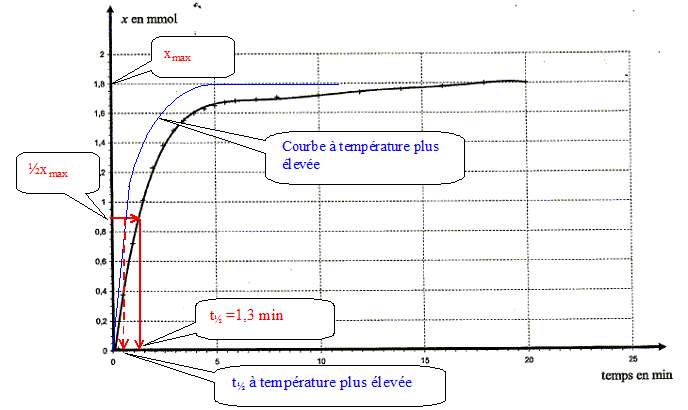
Le facteur cinétique permettant de justifier de cette évolution est la concentration du réactif : au cours du temps celle-ci diminue et en conséquence la vitesse diminue. Temps de demi-réaction et estimation graphique de sa valeur : Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. Ici xfin = xmax = 1,8 10-3 mol donc xt½ = ½xmax= 9,0 10-4 mol.
La température est un facteur cinétique : à température plus élevée la vitesse augmente : la composition finale est plus rapidement atteinte et le temps de demi réaction diminue.
|
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
|