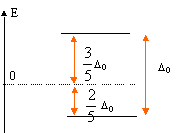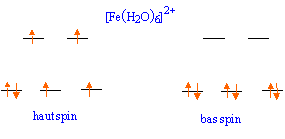|
|
|||||||||
|
|||||||||
|
Théorie du champ cristallin : Les ions cobalt II et cobalt III donne des ions complexes de structure octaèdrique.
données :
D0
énergie d'éclatement du champ cristallin
; P énergie moyenne d'appariement de 2
électrons.
corrigé |
|||||||||
|
Lorsqu'un élément de transition subit l'influence du champ électrostatique de ligands il y a levée partielle de dégénérescence. Dans le cas du champ octaèdrique les O.A se séparent en deux niveaux : niveau t2g : les orbitales dxy, dyz et dxz qui ne pointent pas en direction des ligands sont stabilisées. niveau eg : les orbitales dx²-y² et dz² pointent en direction des ligands et sont déstabilisées. il y a éclatement des niveaux énergétiques en deux sous niveau : D0 énergie d'éclatement du champ cristallin
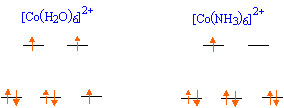
Co2+ : 1s2
2s2 2p6 3s2 3p6
3d7 ; Co3+ : 1s2
2s2 2p6 3s2 3p6
3d6 .
le maximum d'électrons sont appriés et le spin est faible. Un ligand à champ faible est un ligand pour lequel l'éclatement D0 du champ cristallin est inférieur à l'énergie d'appariement P: le maximum d'électrons sont célibataires et le spin est fort. Une substance paramagnétique
possède au moins un électron
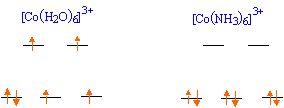
célibataire. ESCC = Eeg - E t2g = [2 * (3/5 D0) - 4 *(2/5 D0)] = -2/5D0 = -87,2 kJ/mol. abaissement de l'énergie du
système.
ESCC = Eeg - E t2g = [ 0 * (3/5 D0) - 6 *(2/5 D0)] = -12/5D0 = -657,6 kJ/mol. énergie totale de la configuration : 6 électrons appariés et seulement 2 électrons appariés pour Co3+ : ESCC + 2P = -657,6 + 2*226 = -205 kJ/mol. abaissement de l'énergie du système.
|
|||||||||
|
ion fer II :
corrigé Fe2+ : 1s2 2s2 2p6 3s2 3p6 3d6 ; D0 = D E = NA hc/l.avec 1 / l =10 000 cm-1 = 106 m-1. D0 = 6,02 1023 * 6,62 10-34 * 3 108 *106 = 119,56 kJ/mol. l'énergie totale de la configuration est : ESCC + n P n : nombre de paires d'électrons appariès
pour une configuration à haut spin ( peu d'appariement) : on observe deux électrons sur le niveau eg et quatre électrons sur le niveau t2g : ESCC = Eeg - E t2g = [2 * (3/5 D0) - 4 *(2/5 D0)] = -2/5D0 énergie du système : -2/5D0 + P = -2/5 *10 000 + 15300 = 11 300 cm-1.
pour une configuration à bas spin ( beaucoup d'appariement) : on observe zéro électrons sur le niveau eg et six électrons sur le niveau t2g : ESCC = Eeg - E t2g = [0 * (3/5 D0) - 6 *(2/5 D0)] = -12/5D0 énergie du système : -12/5D0 + 3P = -12/5 *10 000 + 3*15300 = 21 900 cm-1. la configuration à haut spin est la plus faible en énergie, donc la plus stable : l'eau est un ligand à champ faible. [Fe(NH3)6]2+ : calcul du nombre d'électrons célibataires : le magnéton de Bohr caractérise le nombre n d'électrons célibataires dans une sous-couche 3d. 5,01 = racine carrée (n(n+2)) doù n = 4 la seule configuration possible est : t2g4 eg2.
retour - menu |