|
hydrolyse d'un ester concours Geipi 01
|
|||
|
Le composé E est un ester de masse molaire M=102 g/mol. On réalise à température ambiante un mélange équimolaire: 0,5 mol de E et 0,5 mol d'eau pure. On obtient au bout de plusieurs heures, un mélange d'un monoalcool saturé A et d'acide éthanoïque.
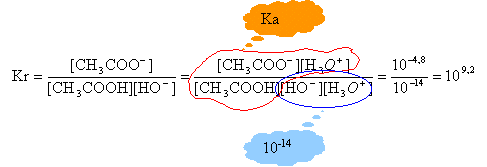
données: pKa (acide acétique/ ion acétate = 4,8; C = 12; O=16 ; H=1 g/mol
|
|||
|
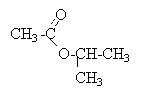
CnH2nO2. 102 = 12 n +2n +32 d'où n = 5 formule brute de E : C5H10O2. l'hydrolyse conduit à l'acide éthanoïque comptant deux carbone. en conséquence A est un alcool saturé à 3 carbone formule brute de A : C3H8O. l'oxydation ménagée de A conduit à une cétone (pas d'action sur la liqueur de Felhing, ni sur le réactif de Tollens) l'alcool A est donc un alcool secondaire: CH3-CHOH-CH3 propan-2-ol. nom de l'ester : éthanoate de méthyléthyle
CH3COOH + HO- -->CH3-COO- + H2O
à l'équivalence la quantité d'acide éthanoïque est égale à la quantité de soude ajoutée: CbVb= 2*0,095 =0,19 mol. quantité de matière d'acide éthanoïque : 0,19 mol il s'est donc hydrolysé 0,19 mol d'ester rendement : 0,19 / 0,5 *100 = 38%. Pour augmenter le rendement de cette hydrolyse: - éliminer l'un des produits au fur et à mesure qu'il se forme (par distillation si l'un des produits est volatil) mettre en excès l'un des réactifs, l'eau par exemple.
retour - menu |