|
concours kiné A P Paris /01.
|
|||
corrigé |
|||
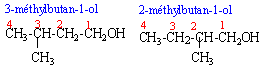
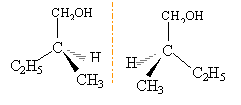
ce sont deux isomères de chaine ( squelette carboné différent) le 2-méthylbutan-1-ol posséde un carbone asymétrique; le second carbone est lié à quatre groupes différents. il existe deux isomères optiques (énantiomères), n'ayant pas les mêmes propriétés sur la lumière polarisée.
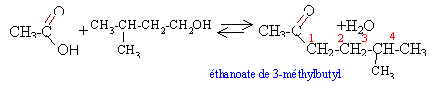
réaction d'estérification, limitée par l'hydrolyse de l'ester, lente, athermique.l'acide sulfurique est un catalyseur. l'augmentation de température (facteur cinétique) permet d'atteindre plus rapidement l'équilibre.
alcool : 17,6 / 88 = 0,2 mol ; d'acide : 12/60 = 0,2 mol les réactifs sont en quantités stoéchiométriques; théoriquement on peut obtenir 0,2 mol d'ester masse molaire ester C7 H14 O2: 7*12+14+2*16= 130 g/mol masse théorique : 0,2*130 = 26g d'ester d'où le rendement : 13 *100/26 = 50% Le rendement peut être augmenté en ajoutant un réactif en excès ou en éliminant l'un des produits du milieu réactionnel au fur et à mesure qu'il se forme. loi de Le Chatelier ou loi de modération ( déplacement d'un équilibre) "La variation d'un facteur d'un équilibre réversible entraîne une évolution du système qui se traduit par une variation opposée du facteur considéré". en remplaçant l'acide
éthanoïque par le chlorure d'éthanoyle ou
par l'anhydride éthanoïque, la réaction
est totale.
C est le 2-méthylbutanal. 3 fois { RCH2OH donne RCHO + 2H+ + 2e-}oxydation Cr2O72- + 6 e- + 14H+ donne 2 Cr3+ + 7H2O réduction. Cr2O72- + 3 RCH2OH +8 H+ donne 2 Cr3+ + 3RCHO + 7H2O D est l'acide 2-méthylbutanoïque (acide carboxylique)
retour - menu |