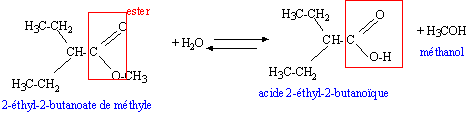|
concours Kiné Nantes 2002 |
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
l'arôme de pomme : Les trois composés clefs de l'arôme de pomme ont pour formules topologiques : 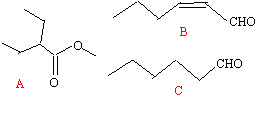
corrigé 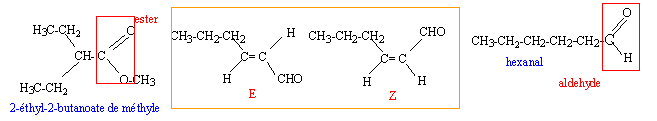
l'oxydation ménagée de l'hexanal conduit à l'acide hexanoïque H3C-(CH2)4-COOH le composé B posséde deux diastéréoisomères Z et E, la rotation autour d'une double liaison C=C étant impossible. l'addition de dihydrogène sur la double liaison C=C du composé B donne le composé C L'hydrolyse de A donne l'acide 2-éthylbutanoïque et un alcool, le méthanol.
|
||||||||||||||||||||||||||||||||||||||||
|
degré d'hydratation du sel de Mohr : Le sel de Mohr est un solide ionique hydraté de formule FeSO4 ; (NH4)2SO4 ; nH2O. cela signifie qu'une mole de ce sel contient une mole de sulfate de fer II, une mole de sulfate d'ammonium et n moles d'eau. Le nombre n est un entier appelé degré d'hydratation.. On pèse 4 g de sel de Mohr et on les dissout dans une fiole jaugée de 100 mL afin d'ontenir une solution aqueuse S1 de sel de Mohr de concentration massique c'1 = 40 g/L. On mélange dans un bécher, un volume V1 = 10 mL de la solution S1 et un volume V2= 5 mL d'une solution S2 d'acide sulfurique ( 2H+ + SO42-) de concentration molaire c2= 1 mol/L. On dose alors les ions fer II par une solution titrante de permanganate de potassium de concentration molaire c0= 0,02 mol/L. Le volume de solution titrante versé à l'équivalence est V0= 10,2 mL.
Potentiels normaux à 25°C : E° (MnO4- / Mn2+) = 1,51 V ; E° (Fe3+/Fe2+) = 0,77 V masse atomique molaire (g/mol) H=1 ; C=12 ; N=14 ; O=16 ; S=32,1 ; K= 39,1 ; Mn= 54,9 ; Fe = 55,8. corrigé 5 fois { Fe2+ --> Fe3+ + e- } oxydation MnO4- + 8 H+ + 5e- --> Mn2+ + 4H2O réduction MnO4- + 8 H+ + 5 Fe2+ --> Mn2+ + 5 Fe3+ + 4H2O l'ion permanganate est oxydant en milieu acide : l'acide sulfurique est l'un des réactifs. avant l'équivalence le liquide est incolore dans l'erlenmeyer ; après l'équivalence l'ion permanganate est en excès, la solution de l'erlenmeyer est violette. A l'équivalence, quantité de matière d'ion permanganate ajouté : 0,02*10,2 = 0,204 mmol d'après les coefficients de l'équation bilan, la quantité de matière d'ion Fe2+ est 5 *0,204 = 1,02 mmol dans 10 mL de solution soit [Fe2+] = 1,02 /10 = 0,102 mol/L. degré d'hydratation du sel de Mohr : 0,102 mol FeSO4 soit : 0,102 *(55,8 + 32+4*16) = 15,48 g 0,102 mol (NH4)2SO4 soit : 0,102 *(18*2 + 32+4*16) = 13,46 g d'où 40-(15,48+13,46) = 11,06 g d'eau 11,06 / 18 = 0,614 mol d'eau 0,604 = 0,102 n soit n = 6. solution électriquement neutre :
solution électriquement neutre : 3[Fe3+] + [NH4+] + [H+] + [K+] +2 [Mn2+]= 2[SO42-] premier membre : 3*0,0397 + 0,0794 + 0,3333 + 0,008 + 2*0,008 = 0,5558 mol/L second membre : 2 *0,2778 = 0,5556 mol/L l'égalité est bien vérifiée.
retour - menu |