|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
|
Obtention du cuivre métallurgique : masse atomique molaire : Cu=63,5 ; O=16 ; S=32 ; g/mol; volume molaire 24 L/mol. Le minerai de cuivre, une pyrite de formule CuS est d'abord grillé dans un grand four rotatif. 2 CuS + 3 O2 --> 2CuO + 2 SO2 L'oxyde de cuivre II récupéré à l'issu du grillage est ensuite réduit par du carbone (coke) 2CuO + C --> 2 Cu + CO2 L'étape intermédiaire a fourni 50 kg d'oxyde de cuivre II
corrigé |
||||||||||||||||||||||||||||||||||||||||
|
Qté de matiére CuO (mol) = masse (g)/ masse molaire (g/mol) 50 000 / 79,5 =628,9 mol
masse théorique de cuivre (g) = masse molaire (g/mol) fois Qté de matière (mol) 63,5 * 628,9 =39,937 kg. volume dioxyde de carbone (L) = volume molaire (L/mol) fois qté de matière (mol) 24*314,45 = 7547
L = 7,55 m3.
n = 628,9 mol den pyrite CuS masse molaire CuS : 63,5+32 = 95,5 g/mol masse CuS (g) = masse molaire (g/mol) fois qté de matière (mol) = 95,5*628,9 = 60 kg. en tenant compte du rendement: masse réelle de pyrite : 60 / 0,7 = 85,7 kg.
|
|||||||||||||||||||||||||||||||||||||||||
|
On considère des cations de même charge électrique mais de rayon différents: Li+ : r = 68 pm; Na+ : r = 98 pm et K+ : r = 133 pm. et des cations de rayons voisins mais de charges différentes: Na+ : r = 98 pm; Ca2+ : r = 100pm et Tl3+ : 95 pm. (1 pm = 10-12 m) On se propose d'étudier l'interaction, en solution aqueuse, entre chaque ion et le dipôle que constitue une molécule d'eau. On note q la charge du cation et d la valeur absolue de la charge partielle du dipôle en interaction avec le cation.
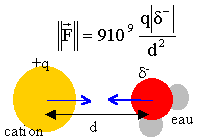
Les charges restent identiques pour les ions sodium, lithium et potassium ; la distance d augmente de 68 à 133 pm, soit du simple au double. les interactions ions-dipôle eau vont décroîtrent du sodium au potassium; l'interaction ion K+ - eau est 2² = 4 fois plus faible que l'interaction ion Na+ - eau.
les interactions ion - eau vont donc respectivement doubler (Ca2+ -eau) puis tripler (Tl3+ - eau) Les
interactions ion-eau sont d'autant plus grandes que l'ion est petit et
fortement chargé.
deux électrons au niveau n=1; 8 électrons au niveau n=2; 1 électron externe au niveau n=3 K2 L8 M1. cet électron externe est facilement perdu (règle de l'octet) Na+ : K2 L8, structure du gaz noble le plus proche, le néon.
deux électrons au niveau n=1; 8 électrons au niveau n=2; 2 électrons externes au niveau n=3 K2 L8 M2. ces 2 électrons externes sont facilement perdus (règle de l'octet) Mg2+ : K2 L8, structure du gaz noble le plus proche, le néon.
deux électrons au niveau n=1; 8 électrons au niveau n=2; 3 électrons externes au niveau n=3 K2 L8 M3. ces 3 électrons externes sont facilement perdus (règle de l'octet) Al3+ : K2 L8,
structure du gaz noble le plus proche, le néon.
pour ces mêmes ions, la distance d diminue: les interactions coulombiennes sont proportionnelles au carré de la distance. les interactions Al3+ - eau seront très fortes (ion petit et fortement chargé) les interactions Na+ - eau seront plus faibles (ion plus gros et peu chargé)
|
|||||||||||||||||||||||||||||||||||||||||
|
radar de la gendarmerie : Le principe de la mesure de la vitesse des véhicules par certains radars de la gendarmerie est le suivant : Le radar fixe installé au bord d'une route émet une onde électromagnétique de fréquence f. Cette onde se réfléchi sur le véhicule se dirigeant vers le radar à la vitesse v. L'appareil mesure le décalage en fréquence Df, entre l'onde incidente et l'onde réfléchie par le véhicule. c= vitesse de la lumière dans l'air = 3 108 m/s. 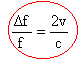
corrigé exprimer les vitesses en m/s : 1m/s = 3,6 km/h 90 / 3,6 = 25 m/s. Df / f = 2*25 / 3 108 = 1,666 10-7 . période (s) = inverse de la fréquence en hertz = 1 / 2,5 109 =4 10-10 s = 0,4 ns Df =2,5 109*1,666 10-7
= 416,6 Hz.
Df / f = 2*1,3888 / 3 108 =9,253 10-9. Df =9,253 10-9*2,5 109 =23,1 Hz.
|
|||||||||||||||||||||||||||||||||||||||||
|
disque de meule: Un disque de meule est en rotation autour d'un axe. L'un de ces points décrit une trajectoire circulaire de rayon r= 5cm. Sa vitesse angulaire constante vaut 4,7 rad/s.
corrigé un tour correspond à 2*3,14 = 6,28 rad. 4,7 / 6,28 = 0,748 tour / seconde 0,748*60 = 44,9 tour /min. vitesse (m/s) = vitesse angulaire (rad/s) fois rayon (m) v= 4,7 * 0,05 = 0,235 m/s.
|
|||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||
|