|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||
|
||||||||||||||||||
|
|
L'eau oxygénée se décompose lentement suivant la réaction : H2O2 --> H2O + ½O2. Un litre d'eau oxygénée à 10 volumes signifie que la décomposition complète de l'eau oxygénée libère 10 L de dioxygène.
corrigé |
|||||||||||||||||
|
25 mL libèrent : 10*25/1000 =0,25 L de dioxygène. équation des gaz parfaits : PV = nRT P= 105 Pa ; V= 0,25 L = 2,5 10-4 m3 ; T= 273+20=293K; R= 8,31 SI n1 =105 *0,25 10-3
/ (8,31 *293) = 10,27 mmol.
n0 - xmax = 0 d'où n0 = 20,54 mmol. 20,54 mmol contenu dans 25 mL d'où [H2O2]= 20,54 / 25 =0,821 mol/L
volume d'air au dessus du liquide : 75 mL = 0,075 L = 7,5 10-2 L = 7,5 10-5 m3. P= 105 Pa; T=293 K; R=8,31 SI. qté de matière d'air: n= 105 * 7,5 10-5 /(8,31*293)= 3 mmol état final : 3 mmol d'air et 10,27 mmol de dioxygène = 13,27 mmol = 13,27 10-3 molde gaz volume : 75 mL = 7,5 10-5 m3 T=293K P= 13,27 10-3*8,31 *293 / 7,5 10-5 = 4,3 105 Pa. |
||||||||||||||||||
|
On réalise la synthèse de l'ammoniac NH3 à partir du dyihydrogène H2 et du diazote N2.
Qtés de matière initiales : H2 : 48/24 = 2 mol N2 : 96 /24 = 4 mol
2- 3x max= 0 donne xmax=0,6666 mol. ou bien 4- xmax= 0
soit xmax= 4 mol.
V0 = 48+96 = 144 L = 0,144 m3.R=8,31 SI. équation des gaz parfaits : PV = nRT P0 = n0RT/V0 = 6*8,31 T / 0,144 = 346,2 T. quantité de matière des gaz lorsque l'avancement est x : 2-3x + 4-x +2x = 6 -2x mol pression du gaz à la date t: P= nRT / V0 avec RT/V0 = P0 / n0 P= (6-2x) P0 / n0 = - 2xP0 / n0 +6 P0 / n0 fonction affine décroissante; droite de coefficient directeur -2P0 / n0
|
||||||||||||||||||
|
dipôle : Un dipôle est formé de deux charges ponctuelles +q et -q situés en deux points A et B tels que AB=2a. Un ion négatif portant la charge -e est disposé en un point P de la médiatrice de [AB], à la distance d du milieu O du segment [AB].
corrigé 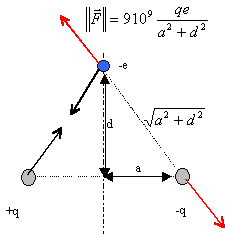
le dipôle va tourner, présenter son pôle positif en regard de la charge négative, puis être attirer par cette charge négative.
|
||||||||||||||||||
|
Jupiter: Les sondes Voyager 1 et 2 avaient pour mission d'explorer le système solaire. La masse de chaque sonde était de 815 kg. Le 5 mars 1979 Voyager 1 s'approcha de Jupiter à l'altitude z1 = 278 000 km et mesura une force gravitationnelle exercée par la planète F1=845 N. Quelques mois plus tard, Voyager 2 ne s'approcha qu'à l'altitude z2 = 650 000 km de cette planète et mesura une force gravitationnelle F2 = 198 N.
corrigé 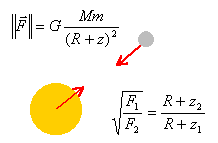
application numérique : (845 / 198 ) ½ = 2,065 2,065R + 2,065 *2,78 108 = R+ 6,5 108. 1,065 R = 7,6 107. R= 7,1 107m = 7,1 104 km. masse de Jupiter : M= F1 (R+z1)² / (Gm) = 845 *(0,71 + 2,78)² 1016 /(6,67 10-11*815)=1,9 1027 kg.
|
||||||||||||||||||
| |
||||||||||||||||||
|