|
spectres d'émission ou d'absorption En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
corrigé |
||||||||||||||||||||||||||||||||||||||||||||||||
|
deux se répartissent sur le niveau n=1 8 se répartissent sur le niveau n=2 4 se répartissent au niveau n=3 K2L8M4. l'atome est dans la troisième kigne ou
période et dans la quatrième colonne (tableau simplifié), donc Si.
atome de sodium : 9 électrons K2L8M1; l'atome perd un électron afin d'aquérir la structure électronique du gaz noble le plus proche le néon donc Na+ : K2L8. atome d'oxygène : 8 électrons K2L6; l'atome gagne deux électrons afin d'aquérir la structure électronique du gaz noble le plus proche le néon donc O2-: K2L8. atome de magnésium : 10 électrons K2L8M2; l'atome perd deux électrons afin d'aquérir la structure électronique du gaz noble le plus proche le néon donc Mg2+ : K2L8. atome d'aluminium : 11 électrons K2L8M3; l'atome perd trois électrons afin d'aquérir la structure électronique du gaz noble le plus proche le néon donc Al3+ : K2L8. atome de fluor : 9 électrons K2L7; l'atome gagne un électron afin d'aquérir la structure électronique du gaz noble le plus proche le néon donc F-: K2L8. AlF3 ; Na2O ; Mg3N2.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Les spectres : compléter les phrases. Un corps chaud ( solide incandescent, étoile) émet une lumière dont le spectre est ………… Un gaz sous pression faible et à température élevée émet une lumière comptant un petit nombre de radiations : on obtient un spectre de …… Les deux spectres précédents sont des spectres d'………… Un gaz à basse pression et à basse température traversé par une lumière blanche absorbe un petit nombre de radiations (celles qu'il est capable d'émettre lorsqu'il est chaud). C'est un spectre d'……….. Sur le fond coloré du spectre de la lumière blanche, on observe des raies ……. Lorsqu'une solution colorée est traversée par une lumière blanche, le spectre de la lumière obtenu présente des …….noires sur le fond coloré de la lumière blanche ( spectres de bandes d'absorption). En examinant le spectre de la lumière émise par une étoile , on peut déterminer sa …….. de surface et la ………. de son atmosphère. corrigé Un corps chaud ( solide incandescent, étoile) émet une lumière dont le spectre est continu Un gaz sous pression faible et à température élevée émet une lumière comptant un petit nombre de radiations : on obtient un spectre de raies Les deux spectres précédents sont des spectres d'émission. Un gaz à basse pression et à basse température traversé par une lumière blanche absorbe un petit nombre de radiations (celles qu'il est capable d'émettre lorsqu'il est chaud). C'est un spectre d'absorption Sur le fond coloré du spectre de la lumière blanche, on observe des raies noires Lorsqu'une solution colorée est traversée par une lumière blanche, le spectre de la lumière obtenu présente des bandes noires sur le fond coloré de la lumière blanche ( spectres de bandes d'absorption). En examinant le spectre de la lumière émise par une étoile , on peut déterminer sa température de surface et la composition de son atmosphère.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
couleur d'une solution : On analyse la lumière transmise par une solution de dichromate de potassium. Le spectrophotomètre donne pour différentes radiations la valeur de l'absorbance A. Si l'absorbance est nulle , la radiation n'est pas absorbée. Plus l'absorbance est grande, plus la radiation est absorbée.
- Dans quel domaine de longueur d'onde l'absorption est-elle importante ? - Dans quel domaine de longueur d'onde la transmission de lumière est-elle importante ? - Quelle peut être la couleur de la solution ? - Dessiner en couleur le spectre de lumière transmise par cette solution lorsqu'elle est éclairée en lumière blanche. corrigé 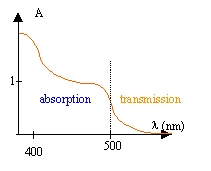
l'absorption est importante entre 380 et 500 nm ; la solution absorbe le bleu et le vert. la couleur de la solution sera la couleur complémenrtaire du bleu , soit le jaune orange. la transmission est importante entre 500 et 600 nm aspect du spectre de bande d'absorption :
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
compléter le tableau suivant :
corrigé
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
