|
bac Antilles 06 /01. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
|
||||||
|
|
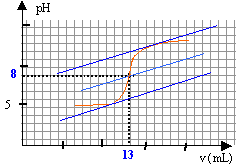
On se propose de doser par pH-métrie un vinaigre afin d'en déterminer la concentration molaire volumique en acide éthanoïque. Pourcela on prépare 100 mL d'une solution diluée10 fois du vinaigre. Puis on prélève un volume V= 10 mL de la solution diluée que l'on verse dans un becher, auquel on ajoute suffisamment d'eau distillée pour que la sonde du pH-mètre soit correctement immergée. On réalise le dosage avec une solution d'hydroxyde de sodium de concentration 0,1 mol/L. Le pH est relevé en fonction du volume ajouté. couple CH3COOH / CH3COO- : pKa =4,8. 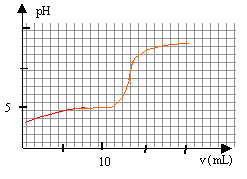
|
|||||
|
à l'équivalence les quantités de matière d'acide et de base sont stoéchiométriques. Avant l'équivalence l'acide est en excés, après l'équivalence la base est en excès. A l'équivalence les espèces majoritaires sont: l'ion éthanoate, l'ion sodium apporté par la soude, les molécules d'eau. la solution contient une base faible, l'ion éthanoate majoritaire, le pH de la solution est donc supérieur à 7. CbVb = CaVa Ca= 0,1*13/10=0,13 mol/L le vinaigre est dix fois plus concentré : 1,3 mol/L.
la solution est une solution tampon: - le pH ne varie pas par dilution - le pH varie très peu lors d'un ajout modéré d'un acide fort ou d'une base forte. pour réaliser 100 mL d'une solution tampon on mélange 50 mL de solution d'acide éthanoïque et 50 mL de solution d'éthanoate de sodium. Les quantités de matière d'acide éthanoïque et d'ion éthanoate sont identiques, donc pH=pKa=4,8. Les volumes sont mesurés à la burette de 50 mL. On utilise une fiole jaugée de 100 mL.
|
||||||
|