|
(quiz) |
|
|
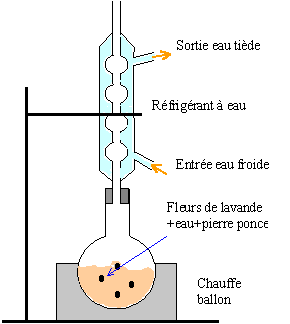
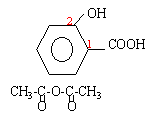
1 préparation de l'aspirine |
|
|
anhydridre acétique plus réactive que l'acide éthanoïque : la réaction d'esterification est complète par contre le matériel doit être bien sec et il faut travailler sous hotte (gants + lunette) |
|
|
purification du produit |
On filtre sur büchner le contenu du vase à réaction. On obtient des cristaux blancs d'aspirine que l'on veut purifier par recristallisation dans le mélange alcool. (acide salicylique et aspirine : très soluble dans l'éthanol, soluble dans l'eau chaude, peu soluble dans l'eau froide) anhydride éthanoïque (soluble dans l'eau et l'éthanol)
corrigé |
|
On utilise la différence de solubilité de l'acide salicylique et des impuretés dans l'eau froide et l'alcool éthylique :
La présence de l'alcool
facilite la dissolution du solide blanc à chaud dans
un petit volume de liquide.
|
|
|
différentes formulations de l'aspirine |
l'aspirine effervescente est associée à l'hydrogénocarbonate de sodium
corrigé |
|
solution tampon: elle contient un couple acide base faible; les quantités de matière d'acide et de base conjuguée sont égales. Le pH d'une solution tampon, ne change pas par dilution, change peu lors de l'ajout modéré d'acide ou de base fort. |
|
|
préparation d'une solution tampon |
On dispose d'une bouteille d'acide éthanoïque sur l'étiquette de laquelle on lit :masse molaire 60 g mol-1 . % massique d'acide 99,8%. C2H4O2. densité 1,05
|
|
concentration de l'acide commercial : masse d'acide dans la bouteille : 0,998*1,05=1,048 kg Qté de matière d'acide en mole :1048/60= 17,46 mol dans 1 L matériel : pipette + pipeteur pour prélever la solution mère fiole jaugée de 1 L + eau distilée 1000*0,1 = V pipette *17,46 --> V pipette = 5,7 mL masse molaire de l'éthanoate de sodium (solide) = 82 g mol-1. peser 8,2 g de solide et dissoudre dans 1 L (fiole jaugée + eau distilée) Mélanger 300 mL de chaque solution, le pH est alors voisin du pKa du couple acide base soit 4,8. étalonage du phmètre avec 2 solutions tampon de pH connu (pH=7 et pH=4) réglage de la température mesure du pH de la solution.
|
|
|
antiseptiques |
corrigé |
|
en présence d'acide chlorhydrique, dégagement de dichlore, gaz toxique. Une eau de Javel à 48° chlorométrique :c'est le nombre de litres de dichlore mesurés à 0°C sous la pression atmosphérique normale que donne l'acidification complète d'un litre d'eau de Javel selon : Cl- + ClO- + 2H+ donnent Cl2 + H2O ion permanganate MnO4- l'ion permanganate et l'eau de Javel sont des oxydants.
retour - menu |