| |
dosage acide fort - base forte En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
|
|
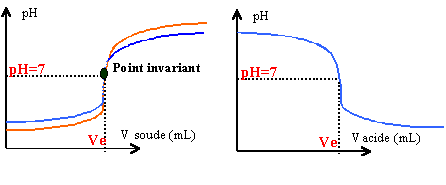
acide fort base forte dosage équivalence |
|
|||||
| |
acide fort : acide chlorhydrique, acide nitrique.
Qté de matière du gaz : 10/ 22,4 = 0,446 mol [H3O+]= 0,446 / 3 = 0,149 mol L-1. pH=-log(0,149)= 0,826
base forte : soude, hydroxyde de potassium.
ions majoritaires : hydroxyde HO- et Na+ ion minoritaire : H3O+. pH = 14 + log (0,01)= 12 pour S0. pour S, on néglige les ions apportés par l'eau : Cbase = [HO-] = [Na+] =0,05*0,01 / 3,05 = 1,64 10-4 mol L-1. pH = 14 + log (1,64 10-4)= 10,2 pour S. H3O+ + HO- --> 2 H2O réaction totale, exothermique, rapide. Quantité de matière des réactifs : acide : 0,02*0,01 = 2 10-4 mol base : 0,008*5 10-3 = 4 10-5 mol 4 10-5 mol de soude réagi avec 4 10-5 mol d'acide. Il reste 1,6 10-4 mol d'acide dans 28 mL de solution . [H3O+]=1,6 10-4 /28 10-3 = 5,7 10-3 mol L-1. pH = -log(5,7 10-3 )= 2,2 A l'équivalence les quantités de réactifs mises en présence sont proportionnelles aux coefficients de l'équation bilan. L'équivalence peut être repérée par le changement de couleur d'un indicateur coloré. CAVA = CBVB VB= 0,02*0,01 / 5 10-3 = 40 mL. Il se forme 0,02*0,01 = 2 10-4 mol de chlorure de sodium NaCl. Soit en masse : 58,5 *2 10-4 = 0,0117 g.
|
||||||
|
|
|