|
.
. |
oxydo réduction En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
azote |
corrigé |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
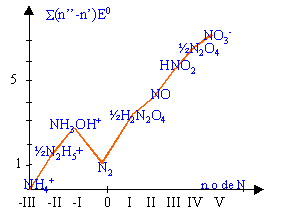
n.o de l'azote dans les différentes espèces : NH4+ : x+4= 1 ( charge de l'ion) donc -III. N2H5+: 2x+5= 1 ( charge de l'ion) donc -II. NH3OH+: x+3 -2 +1 = 1 ( charge de l'ion) donc -I. N2: corps pur simple donc 0. H2N2O2: 2+2x-4=0 donc +I. NO: x-2=0 donc +II. HNO2: 1+x-4 =0 donc +III. N2O4: 2x-8=0 donc +IV. NO3-: x-6=-1 donc +V.
diagramme de Frost: NH4+ est pris comme origine.
Une espèce se dismute si elle se trouve au dessus du segment joignant ces deux plus proches voisins
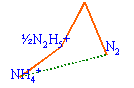
N2H5+ ne se dismute pas en NH4+ et NH3OH+. NH4+ et NH3OH+ et N2H5+ étant à peu près alignés peuvent être en équilibre
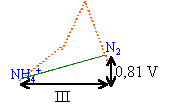
N2H5+ se dismute en NH4+ et N2. de même N2O4 se dismute en NO3- et HNO2. HNO2 se dismute en NO3- et NO. (synthèse acide nitrique) H2N2O4 se dismute en N2 et NO. espèces stables : celles qui se trouvent en dessous du segment joignant deux autres entités. NH4+ ; N2 ; NO3-. La pente ou coef directeur du segment joignant deux points du diagramme de Frost est égale au potentiel standart relatif à ce couple redox. NH4+ / N2 : E0 = 0,81 /3 =0,27 V
de même : N2 / NO3- : E0 = (7,03-0,81) / 5 = 1,24 V NH4+ / NO3- : E0 = 7,03 / 8 = 0,88 V
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
combinaisons de diagrammes de Frost de différents éléments |
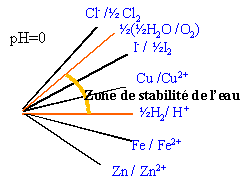
La pente de chaque segment correspond au potentiel standart du couple. Tout oxydant d'un couple situé au dessus de la zone de stabilité de l'eau peut oxyder l'eau en O2. Tout réducteur d'un couple situé au dessous de la zone de stabilité de l'eau peut réduire l'eau en H2.(c'est le cas du fer et du zinc) Tout couple dont le segment se trouve à l'intérieur de la zone de stabilité thermodynamique de l'eau , ne réagit pas avec l'eau. toutes les prévisions à partir des diagrammes de Frost ne tiennent pas compte des facteurs cinétiques. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||