5 fiches de cours interactives
|
|
|
|
|
corrigé
oxydation douce
(KMnO4 en défaut + acide sulfurique)
l'alcool primaire donne un aldehyde mis en évidence par le test de Tollens
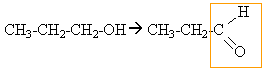
l'alcool secondaire conduit à une cétone mise en évidence par le test à la DNPH

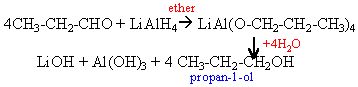
Réactif de Tollens
[Ag(NH3)2]+ ,
NO3-
liqueur de Fehling [Cu(tartrate)2]2-
sont réduits par les
aldehydes respectivement en argent et Cu2O rouge
brique.
|
|
|
|
|
|
|
Une cétone aliphatique A traitée par du chlorure de méthylmagnésium donne un composé B ; B donne C par hydrolyse ; C se déshydrate en milieu acide et conduit à D par ozonolyse conduit à l'éthanal et à la butanone.
|
corrigé
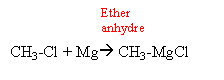
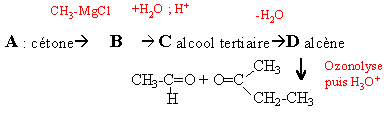
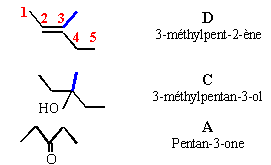
B chlorure d'alkoxyde magnésium
La présence du zinc rend le milieu réducteur et
évite l'oxydation ultérieure des aldehydes éventuellement formés en acides carboxyliques.
|
3 isomères possibles
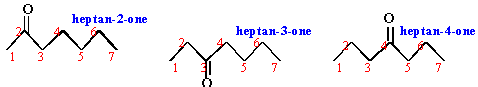
En milieu basique dismutation de l'iode
I2 + 2 OH- --> I- + IO- + H2O
Le produit jaune est du triodométhane CHI3 ou iodoforme
C
est donc une cétone a
méthylée :
heptan-2-one
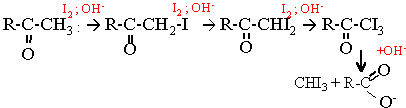
La cétone a iodée est plus réactive que la cétone elle même.
R-CO-CH3 + 3I2 + 4OH- --> R-COO- + CHI3 solide + 3I- + 3H2O
Il y a consommation de 3 moles d'iode par mole de cétone soit :761,4 g d'iode.