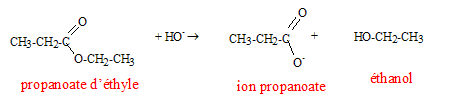En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
|
Texte : conditions expérimentales : soude assez concentrée et chauffage à reflux.. Analyse : Questions relatives à la réaction. Cette réaction s'appelle " hydrolyse basique " ou " saponification". Cette réaction est lente mais totale : elle ne conduit pas à un état d'équilibre. Questions relatives aux produits.
L'un des produit formé est l'éthanol et non pas le propanol. L'autre produit formé est l'ion propanoate ( majoritaire en milieu basique par rapport à l'acide propanoïque), base conjuguée de l'acide propanoïque.
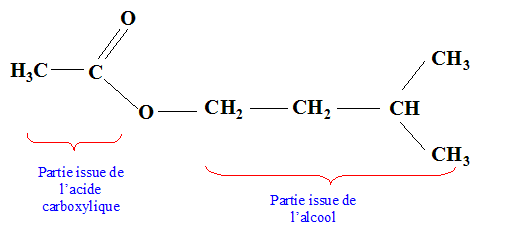
CH3-COO-CH2-CH2-CH(CH3)2.
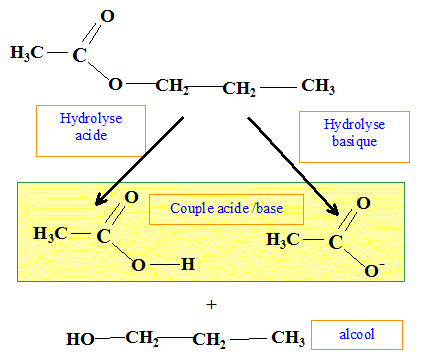
Hydrolyse acide, hydrolyse basique. Formule brute : C5H10O2 : En milieu acide, l'hydrolyse donne un corps A et un corps B. En milieu basique, l'hydrolyse le même corps A et un corps D. Analyse : Question relative à l''hydrolyse.
Le corps A est un alcool : B est un acide carboxylique. L'hydrolyse acide est limitée ; l'hydrolyse basique est lente mais totale. Le corps B se transforme en D en milieu basique. acide carboxylique + HO- = ion carboxylate + eau.
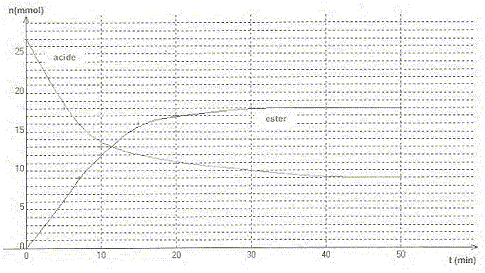
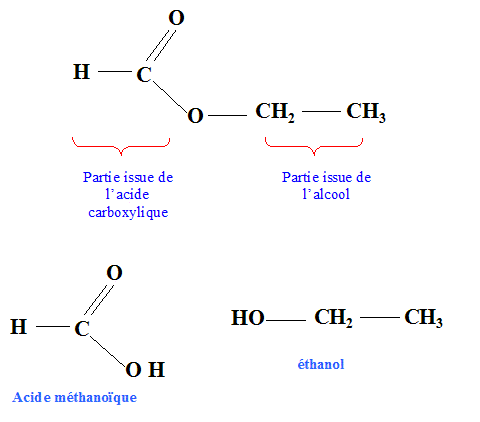
Le méthanoate d'éthyle. Texte : mélange initial équimolaire en acide carboxylique et en alcool. L'évolution des quantités d'ester et d'acide en fonction du temps sont données.
Analyse : Questions relatives aux noms des réactifs.
Questions relatives à la constante d'équilibre. Le tableau d'évolution est établi pour 27 mmol d'alcol et 27 mmol d'acide ( valeur lue sur le graphe ci-dessus) ; le volume total est noté V (mL).
[HCOOH]éq=(27-xéq)/V = 9/V ; [CH3-CH2OH]éq=(27-xéq)/V =9/V; [HCOO-CH2-CH3]éq=18/V ; [H2O]éq=18/V. K = [H2O]éq[HCOO-CH2-CH3]éq/ ([HCOOH]éq[CH3-CH2OH]éq) K =182/92 = 4. Question relative au taux d'avancement final. t = xéq/xmax = 18 /27 = 0,67 (67 %) Question relative à la pureté de l'ester. La mesure de latempérature d'ébullition de l'ester ne permet pas de contôler sa pureté. La chromatographie sur couche mince (CCM) permet de contôler la pureté.
Le palmitate de myricyle CH3-(CH2)14COO-(CH2)29-CH3, Texte : un
dispositif de chauffage à reflux contient : n moles
de palmitate de myricyle, 100 mL d'une solution alcoolique
d'hydroxyde de potassium à 0,30 mol/L. Question relative aux réactions. hydrolyse basique ou saponification lente, totale. Question relative à la
formule du savon. Question relative à quantité de matière de potasse. Qté de matière de potasse initiale :
0,3*100 = 30 mmol A l'équivalence du dosage acide base, les quantités de matière d'acide et de base mises en présence sont en proportions stoechiométrriques d'où 10*0,15 = 1,5 mmol Question relative à la masse de savon. CH3-(CH2)14COO-(CH2)29-CH3
+ HO- +K+=
CH3(CH2) 14-COO-
+
K++HO-(CH2)29-CH3 M(savon) = 16*12+31+32+39=294 g/mol |
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
|