|
Pile zinc fer. |
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
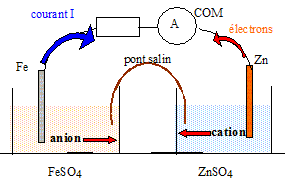
Texte :Soit une pile zinc fer qui met en jeu les couples oxydant / réducteur Zn2+aq/Zn(s) et Fe2+aq/Fe (s). Le pont salin de la pile contient des ions potassium K+ et chlorure Cl-. Cette pile débite dans un circuit série comprenant un ampèremètre et un dipôle ohmique. L'ampèremètre affiche une valeur positive de l'intensité I alors que sa borne COM est reliée à l'électrode de zinc. On considère que l'intensité du courant I est constante. Au bout d'une heure de fonctionnement la masse de l'électrode de fer a augmenté d'une masse m1 = 56 mg. Analyse : Faire un schéma légendé de la pile branchée au circuit extérieur en faisant apparaître le sens de déplacement des porteurs de charges.
Exprimer chacune de ces trois quantités de matière en fonction de l'avancement x de la transformation : n1 de fer qui apparaît ou disparaît, n2 de zinc qui apparaît ou disparaît, ne d'électrons échangés.
Déterminer l'avancement x au bout d'une heure. 1 F = 9,65 104 C. M(Fe) = 56 g/mol. Quantité de matière de fer formée n1 = m1/ M(Fe) = 56 10-3 / 56 = 10-3 mol. Déterminer la variation de masse m2 de l'électrode de zinc au bout d'une heure. M(Zn) = 65 g/mol. n2 = x = n1 = 10-3 mol La masse de zinc diminue de : m2 = n2M(Zn) =10-3 *65 = 65 mg. Etablir l'expression de I en fonction de la quantité de matière ne, du faraday F et de la durée de l'expérience Dt. Quantité d'électricité Q = I Dt = ne F soit I = ne F / Dt . Calculer la valeur de I. Aide aux calculs : 9,65/3,6 = 2,7 I = ne F / Dt = 2 10-3 *9,65 104 / 3600 =2*96,5/3600 =2*9,65 / 3,6 * 10-2 = 2*2,7 10-2 = 0,054 A.
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|