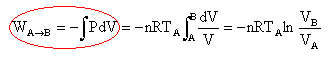|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
Le cycle comprend une isotherme AB, une adiabatique CA, une isochoreBC. La masse de gaz est constante. 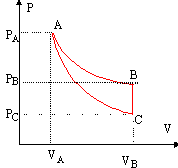
corrigé La variation d'entropie DS est nulle sur le cycle. la variation d'entropie est égale à la somme de l'entropie échangée et de l'entropie crée : DS = S éch + S crée. or S crée est positive ou nulle ; donc S éch est négative ou nulle or S éch = Q / T donc Q négatif ou nulle. La variation d'énergie interne est nulle sur le cycle. DU = Q + W =0 Q étant négatif alors le travail W est positif. conclusion : une seule source de chaleur étant disponible, alors le système: - céde un transfert thermique vers l'extérieur Q <=0 - reçoit du travail W>=0 c'est un récepteur.
Au point A : TA = PA VA / (nR)= 106 * 8 10-5 /(3,45 10-2 *8,32) =279 K. la transformation AB étant une isotherme alors TB = 279 K. Au point C : pour une transformation adiabatique réversible : PA VA g =PC VC g . VC g = PA / PC VA g = 10 (8 10-5)1,4 soit VC = 10 1/1,4 *8 10-5 = 4,14 10-4 m3. la transformation BC étant une isochore alors VB = 4,14 10-4 m3. TC = PC VC / (nR)= 105 * 4,14 10-4 /(3,45 10-2 *8,32) =144,2 K. Au point B : la transformation AB est une isotherme PA VA = PB VB. PB
=PA VA / VB =
106 * 8 10-5 / 4,14 10-4 =
1,93
105 Pa.
WA-->B = -3,45 10-2 *8,32 *279 ln(41,4 / 8) = -132 J. au cours de la transformation BC isochore, le volume reste constant : le travail est nul. au cours de la transformation adiabatique CA, pas déchange de chaleur avec l'extérieur, le travail mis en oeuvre est égal à la variation d'énergie interne du gaz. WC-->A = DU = nCv(TA-TC) = n R /(g -1)(TA-TC) WC-->A =3,45 10-2 *8,32 / 0,4 *(279-144,2)= 98 J. travail
total sur le cycle : -34
J.
la température est constante, alors la variation d'énergie interne est nulle. DU = WA-->B +QAB = 0 QAB = -WA-->B =132 J. au cours de la transformation adiabatique CA pas de transfert thermique. au cours de la transformation BC isochore, le volume reste constant : le travail est nul. DU = QBC = nCv(TC-TB) = n R /(g -1)(TC-TB) QBC = 3,45 10-2 *8,32 / 0,4 *(144,2-279)= -98 J. soit Q total = +34 J. |
|
|
Deux sources de chaleur sont nécessaires pour réaliser réversiblement un cycle composé de deux isothermes AB et CD et deux isochores BC et DA. La masse de gaz est identique à celle de la première partie. 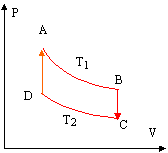
corrigé isotherme AB : la température étant constante, la variation d'énergie interne est nulle DU = Q + W =0 soit Q = -W travail élémentaire des forces de pression : dW = -PdV PV = nRT1 donne PdV + VdP = 0 soit dW = VdP = nRT1 / P dP = nRT1 d ln P travail W A-->B = nRT1 ln(PB /PA) QA-->B = nRT1 ln(PA /PB) positif car PA >PB de même sur l'isotherme CD :
Q C-->D =
nRT2 ln(PC /PD)
négatif car
PC <PD
le travail des forces de pression est nul et la variation d'énergie interne du gaz est égale à QB-->C DU = QB-->C = nCv(TC-TB) = n R /(g -1)(T2-T1) négative car T2<T1 de même sur l'isochore DA : DU
= QD-->A =
nCv(TD-TA)
= n R
/(g
-1)(T1-T2)
positive car
T2<T1
Q1 = nRT1 ln(PA /PB) + n R /(g -1)(T1-T2). transfert Q2 négatif : Q2 =nRT2 ln(PC /PD) + n R /(g -1)(T2-T1) rendement : la variation d'énergie interne est nulle sur le cycle donc W +Q1 + Q2 = 0 h= -W/ Q1 = (Q1 + Q2 )/ Q1 = 1 + Q2/ Q1 h = 1+ [T2 ln(PC /PD) + 1 /(g -1)(T2-T1)] / [T1 ln(PA /PB) + 1 /(g -1)(T1-T2)] or PD = nRT2/ VA et PA / PB = VB / VA =VC / VD = nRT2/ (PCVA) h = 1+ [T2 ln(PCVA /(nRT2)) + 1 /(g -1)(T2-T1)] / [T1 ln(nRT2/ (PCVA)) + 1 /(g -1)(T1-T2)]. h = 1+a T2/T1 avec a = ln(PCVA /(nRT2)) + 1 /(g -1)(1-T1/T2)] / [ ln(nRT2/ (PCVA)) + 1 /(g -1)(1-T2/T1)]. le rendement du cycle de Carnot est : hcarnot = 1 - T2 / T1. si a est inférieur ou égal à -1 alors h <= hcarnot . a est-il bien inférieur à -1? ln(PCVA /(nRT2)) + 1 /(g -1)(1-T1/T2)] <= -[ ln(nRT2/ (PCVA)) + 1 /(g -1)(1-T2/T1)]. 1-T1/T2<= -1+T2/T1 soit 2 <=T2/T1 +T1/T2 soit (T1-T2 )>0 vrai.
T1 = 8 10-5*4 106/(8,32*3,4510-2) = 1114,8 K. PA /PB=0,0345*8,32*300 / 8 = 10,76 Q1 = 3,45 10-2 *8,32[1114,8 ln 10,76 + 1 /0,4 *(1114,8-300)] = 1345 J. Q2 = 3,45 10-2 *8,32 [300 ln(1/10,76) + 1 /0,4(300-1114,8)]= -789 J. h= 1- 789 / 1345 = 0,41. hcarnot= 1 -300/1114,8 = 0,73.
retour - menu |