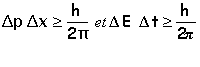|
|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
Le principe de superposition: Les particules atomiques peuvent exister dans plusieurs états superposés et simultanés. Cet état de superposition cesse immédiatement dès qu'il y a observation, et donc interaction, de la particule; un système A et B devient un système A ou B.
|
|||||
|
Max Planck |
En 1900 Planck étudie le rayonnement du corps noir. (système clos et thermiquement isolé, par exemple un four : l'orifice d'observation est de petites dimensions). Il suppoque que les échanges d'énergie entre les parois du corps noir, au lieu d'être continu, s'effectuent par quantités finies d'énergie ou quanta (quantum signifie quantité en latin). Pour une fréquence n donnée il pose : E = h n. h est une constante , la constante de Planck. Planck découvrit les quanta mais n'a pas su les interpréter correctement. |
|||||
|
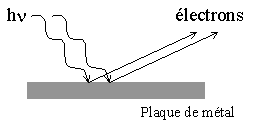
effet photoélectrique |
L'émission d'électrons n'étant conditionnée que par la fréquence du rayonnement seule la théorie des quanta donne une explication. Les échanges d'énergie entre rayonnement et matière s'effectue par paquets finis d'énergie . |
|||||
|
Einstein et le photon |
Ec = hn -hn0 n0 étant la fréquence à partir de laquelle l'effet photoélectrique est observé. 1905 : La lumière est constituée de paquets d'énergie qui sont absorbés ou émis par la matière. La lumière ou toute onde électromagnétique est constituée de grains ou corpuscule ou photons. |
|||||
|
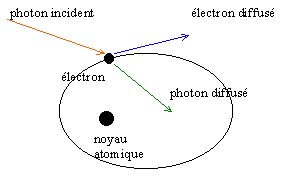
effet Compton |
A la suite de ces résultats, il fallut admettre l'hypothèse du photon avancée par Einstein : la lumière a un double comportement, celui d'un corpuscule localisé dans l'espace et celui d'une onde, phénomène qui s'étend dans l'espace et le temps et donc non localisé.
|
|||||
|
la mécanique ondulatoire .Louis de Broglie |
d'après la théorie des quanta E = h n = h c /l d'après la théorie de la relativité E = p c d'où l = h /p Quantité de mouvement p=mv vitesses non relativistes Cette relation fondamentale relie une longueur d'onde, propriété ondulatoire à la quantité de mouvement, propriété de la mécanique des corpuscules. En 1927, la diffraction des électrons par un cristal confirme l'hypothèse de Louis de Broglie.
|
|||||
|
principe d'Heisenberg |
Si on connaît parfaitement la position d'un objet quantique, alors on ne peut pas connaître sa quantité de mouvement. Inversement si on connaît sa quantité de mouvement, alors on ne peut pas connaître sa position.
Dp, Dx, DE, Dt incertitudes respectivement sur la quantité de mouvement, la position, l'énergie, la durée de la mesure de l'énergie, h la constante de Planck.
Plus la durée est brève, plus l'incertitude sur la valeur de l'énergie est grande: le principe de conservation de l'énergie n'est plus vérifié. |
|||||
|
équation de Schrödinger |
Le carré de l'amplitude de l'onde associée à une particule en un point représente la probabilité de présence de la particule en ce point. |